Vous êtes ici : Accueil Cité des Énergies > ACCUEIL BIAM > Recherche > IPM > Équipement IPM
Nos équipements
L’équipe des Interactions Protéine Métal possède un spectromètre de masse « micro TOF-Q » (Bruker) de géométrie hybride type Q-TOF (quadripole – Time Of Flight) doté d’une source electrospray (ESI).
Le spectromètre de masse ESI Q-TOF permet d’effectuer des analyses de haute précision aussi bien pour des protéines ou des complexes protéiques de haut poids moléculaire que pour des peptides ou des molécules de faibles tailles. Différentes caractérisations des protéines sont ainsi possibles :
- Détermination de la masse exacte des protéines et peptides
- Contrôle de l’expression, de la modification, de la mutation et du marquage des protéines et peptides
- Analyse de protéolyse ménagée des protéines
- Étude de complexes protéiques par spectrométrie de masse native.
Des études des interactions au sein de complexes non covalents de type protéine/partenaires, identification des partenaires et stœchiométrie (protéines/protéines – protéines/métaux – protéines/cofacteurs – protéines/ADN) sont réalisables par spectrométrie de masse à partir des échantillons en phase liquide dans un tampon biologique volatile. L’analyseur TOF couplée à une source electrospray permet ces mesures de complexes non-covalents grâce à une gamme de masse en valeurs de m/z (masse sur charge) importante. (Leney AC, Heck AJ (2017) Native Mass Spectrometry: What is in the Name? J Am Soc Mass Spectrom. 28:5-13)
Quelques exemples d’applications en spectrométrie de masse
Mise en évidence de la présence de partenaires par spectrométrie de masse non covalente
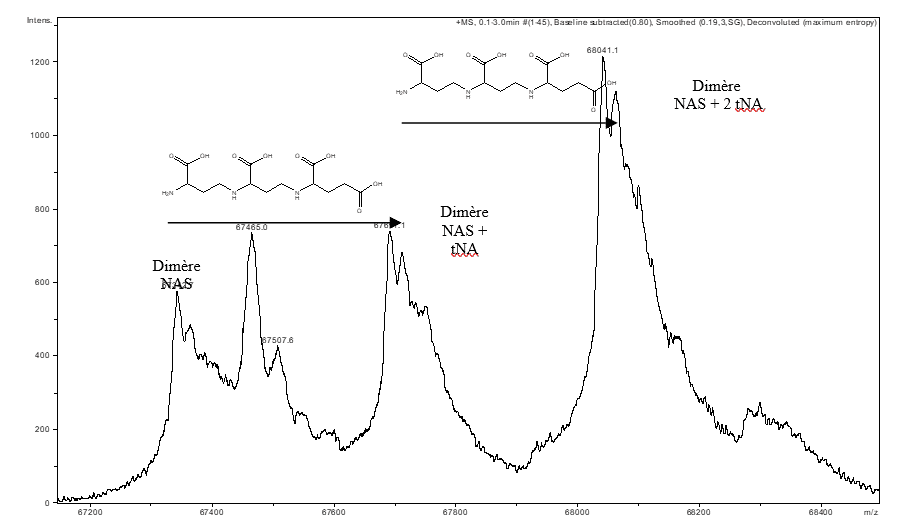
La spectrométrie de masse dite non covalente permet de préserver l’intégrité des complexes maintenus par des interactions non covalentes dans le but d’identifier les partenaires au sein d’un complexe et leur stœchiométrie. Ce type de mesure a permis de mettre en évidence la présence d’un ligand tNA (thermoNicotianamine) au sein d’une nicotianamine synthase (NAS) issue de Methanothermobacter thermautotrophicus (Figure A). (Dreyfus & al. PNAS 2009)
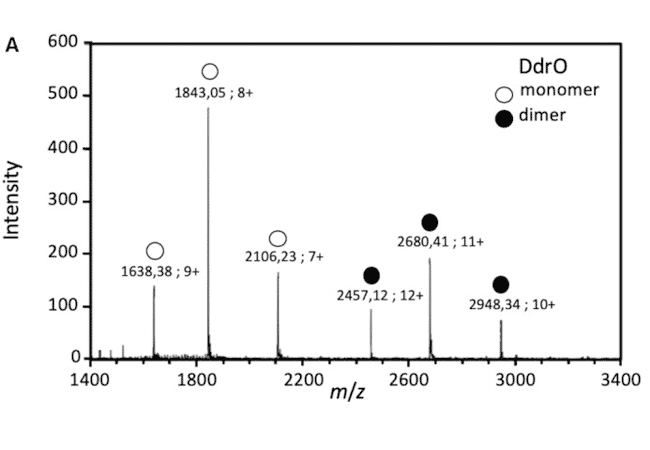
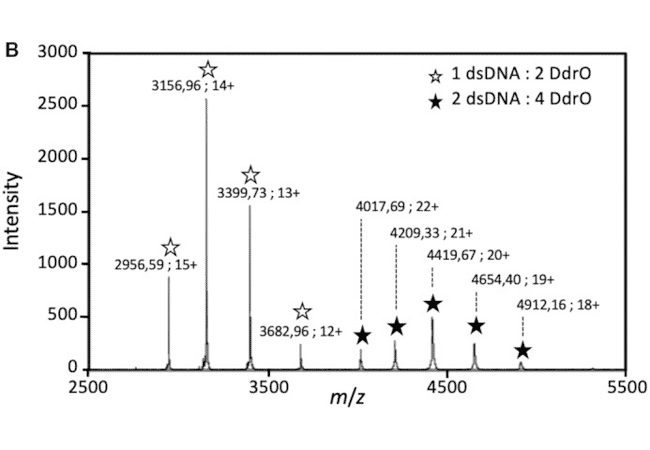
La mise en évidence de complexes protéines/ADN a été obtenue par spectrométrie de masse native dans le cadre d’une étude de la réparation de l’ADN chez deinococcus : interaction entre le répresseur transcriptionnel DdrO et l’ADN (Figure B). (de Groot & al. Nucleic Acids Res. 2019)
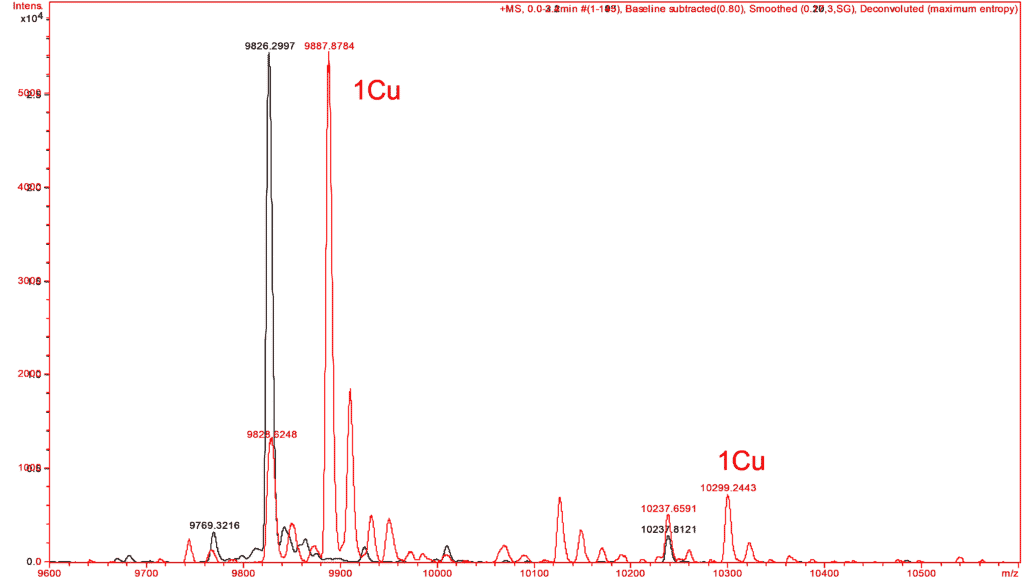
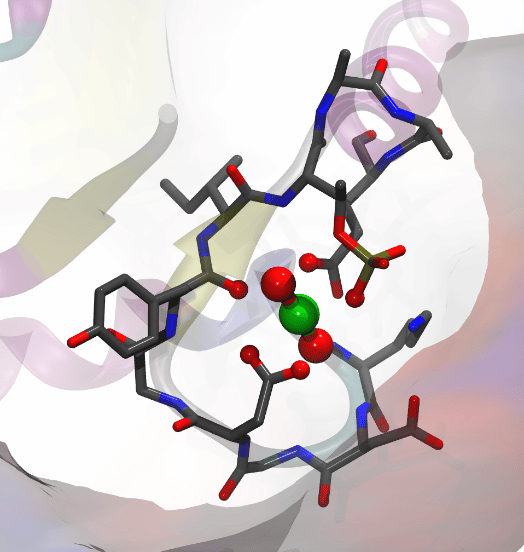
De la même manière, des expériences similaires ont permis de vérifier la complexation par le cuivre d’une petite protéine. Les spectres de masse de celle-ci sont réalisés en absence et en présence de cuivre reconstituant le complexe attendu à partir de la forme apo de la protéine et de vérifier ses partenaires métalliques (Figure C).
Interactions protéine-métal ou protéine ligands par spectroscopie IRTF en mode de réflexion totale atténuée couplée à a la micro-dialyse
Une approche de dialyse –couplée à l’acquisition de spectres en mode de réflexion totale atténuée, nous permet d’identifier dans le domaine IR moyen, les changements structuraux associés à la fixation d’un métal dans une protéine et la nature des groupements chimiques impliqués dans la coordination du métal (Gourion-Arsiquaud et al. 2005, Vidaud et al. 2007). Cette approche peut être élargie à la fixation de différents types de ligands.
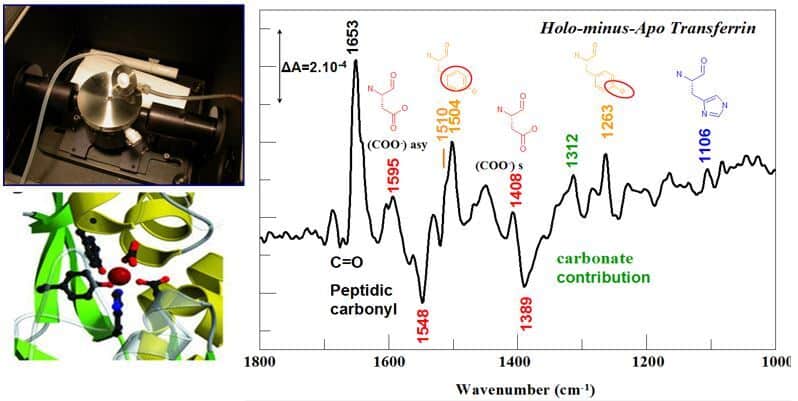
La spectroscopie ATR FTIR peut également être utilisée sur de petites protéines ou peptides sous forme de films déshydratés, pour comparer les formes apo et les formes ayant fixé le métal. En déterminant notamment la présence de ligands carboxylates monodentes ou bidentes, et l’implication de groupement phosphoryles dans la chélation de l’uranyle par le site EF-hand de la calmoduline, cette approche s’avère très complémentaire des approches d’absorption des rayons X (XAS – EXAFS) pour caractériser les sites métalliques dans les protéines (Sauge-Merle et al. 2017).
Spectro-électrochimie dans les domaines IR moyen et lointain
Nous avons optimisé des dispositifs permettant de coupler électrochimie et spectroscopie IRTF dans les domaines IR-moyen et lointain et d’utiliser la ligne AILEs du synchrotron SOLEIL (Dalla Bernardina et al. 2014). Le domaine IR moyen renseigne sur les propriétés des groupes fonctionnels de la protéine, tandis que le domaine IR lointain permet d’identifier les propriétés des interactions métal-ligand (Marboutin et al. 2011). Avec la protéine modèle azurine, nous avons montré qu’il est possible de détecter des liaisons hydrogène intermoléculaires impliquant des molécules d’eau vers 200 cm-1 et les conséquences de ces liaisons sur les propriétés des liaisons métal-ligand (Vita et al. 2013). Nous étudions actuellement les propriétés des cytochromes et des centres Fer-Soufre des ferredoxines (Motomura et al . 2019, Zuccarello et al. 2020)
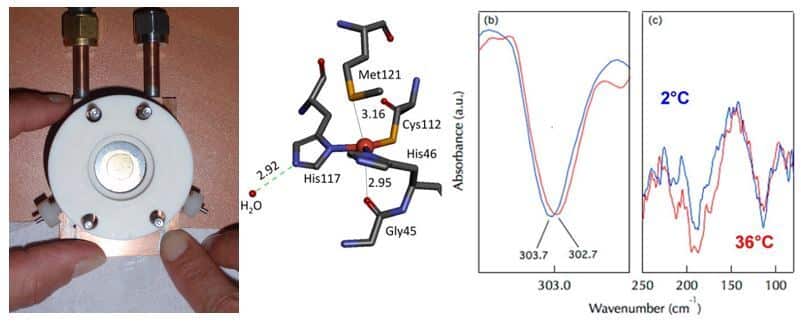
Analyse de processus photochimiques dans les protéines par couplage de la photochimie et de la spectroscopie IRTF, à température ambiante ou cryogénique
Nous étudions les réactions photochimiques du photosystème II et de la Fatty Acid Photodecarboxylase par couplage de la photochimie et de la spectroscopie IRTF en mode différentiel dans les domaines IR moyen à température ambiante ou cryogénique (Sorrigué et al. 2021 ) ou dans le domaine IR lointain (Zuccarello et al. En préparation).
Nos équipements consistent en deux spectromètres Bruker Vertex 70V et 66S FTIR équipés de détecteurs MCT et d’un Bolomètre à Si Bolometer, un ATR SensIR et un laser Nd-Yag doublé.
Références bibliographiques
- Gourion-Arsiquaud S, Chevance S, Bouyer P, Garnier L, Montillet JL, Bondon A, Berthomieu C (2005) Identification of a Cd2+ and Zn2+ binding site in cytochrome c using FTIR coupled to an ATR micro-dialysis set-up and NMR spectroscopy. Biochemistry 44, 8652-8663.
- Vidaud C, Gourion-Arsiquaud S, Rollin-Genetet F, Albert C, Plantevin S, Pibbe O, Berthomieu C, Quemeneur E (2007) Structural consequences of UO22+ binding to apotransferrin : can this protein account for uranium entry into human cells ? Biochemistry 46, 2215-2226.
- Marboutin L, Petitjean H, Xerri B, Vita N, Dupeyrat F, Flament JP, Berthomieu D, Berthomieu C (2011) Profiling the active site of a cuproenzyme through its far-infrared fingerprint (680-50 cm-1). Angew Chem Int Ed Engl. 50, 8062-8066.
- Vita N, Brubach JB, Hienerwadel R, Bremond N, Berthomieu D, Roy P, Berthomieu C (2013) Electrochemically-induced far-Infrared difference spectroscopy on metalloproteins using advanced synchrotron technology. Anal. Chem. 85, 2891-2898.
- Dalla Bernardina, S, Alabarse F, Kalinko A, Roy, P, Vita N, Hienerwadel R, Berthomieu C, Judeinstein P, Zanotti J-M, Bantignies JL, Haines J, Catafesta J, Creff G, Manceron L, Brubach JB (2014) « New experimental set up for studing nanoconfined water on the AILES beamline at SOLEIL ». Vibrational Spectroscopy, http://dx.doi.org/10.1016/j.vibspec.2014.07.016
- Sauge-Merle S, Brulfert F, Pardoux R, Solari PL, Lemaire D, Safi S, Guilbaud P, Simoni E, Merroun ML, Berthomieu C. (2017) Structural Analysis of Uranyl Complexation by the EF-Hand Motif of Calmodulin: Effect of Phosphorylation. Chemistry. 23, 15505-15517.
- Motomura T, Zuccarello L, Sétif P, Boussac A, Umena Y, Lemaire D, Tripathy JN, Sugiura M, Hienerwadel R, Shen JR, Berthomieu C. (2019) An alternative plant-like cyanobacterial ferredoxin with unprecedented structural and functional properties. Biochim Biophys Acta Bioenerg. 1860(11):148084
- Zuccarello L, Berthomieu C, Boussac A, Brubach JB, Díaz-Moreno I, Díaz Quintana AJ, Hienerwadel R (2020) Protonation of the Cysteine Axial Ligand Investigated in His/Cys c-Type Cytochrome by UV-Vis and Mid- and Far-IR Spectroscopy. J Phys Chem Lett. 11, 4198-4205. doi: 10.1021/acs.jpclett.0c01016.
- Sorigué D, Hadjidemetriou K, Blangy S, Gotthard G, Bonvalet A, Coquelle N, Samire P, Aleksandrov A, Antonucci L, Benachir A, Boutet S, Byrdin M, Cammarata M, Carbajo S, Cuiné S, Doak R B, Foucar L, Gorel A, Grünbein M, Hienerwadel R, Hilpert M, Kloos M, Lane TJ, Légeret B, Legrand P, Li-Beisson Y, Moulin S, Nurizzo D, Peltier G, Schirò G, Shoeman RL, Sliwa M, Solinas X, Zhuang B, Barends TRM, Colletier J-P, Joffre M, Royant A, Berthomieu C*, Weik M*, Domratcheva T*, Brettel K, Vos MH*, Schlichting I, Arnoux P*, Müller P*, Beisson F* (2021) Mechanism and dynamics of photodecarboxylase. Science 372, eabd5687, DOI: 10.1126/science.abd5687
Responsable d’équipe Virginie CHAPON
Mots clés
Metalloproteins structure-fonction; Nuclear toxicology; Biosensors; Bioremediation; Metal stress; Radionuclides