Vous êtes ici : Accueil Cité des Énergies > ACCUEIL BIAM > Recherche > MEM > Thèmes de recherche MEM
Thèmes de recherche
Radiorésistance bactérienne et détection du stress oxydant
Par Laurence Blanchard et Arjan de Groot
Nos recherches visent à décrypter les mécanismes moléculaires qui confèrent aux Déinocoques une résistance extrême aux radiations et aux stress qui endommagent l’ADN (e.g. dessiccation, UV, mitomycine C (antibiotique, anti-cancéreux), stress oxydant en général). Dans ce contexte, nos travaux se concentrent sur la caractérisation de Deinococcus deserti, une bactérie radiorésistante isolée du désert du Sahara, présentant des caractéristiques originales – par rapport notamment à l’espèce modèle Deinococcus radiodurans – mises en évidence par protéo-génomique comparative (De Groot et al. (2009) PLoS Genet). L’exploration de la biodiversité des Deinococcus, isolées de divers environnements dans le monde, est également au cœur de nos études actuelles.
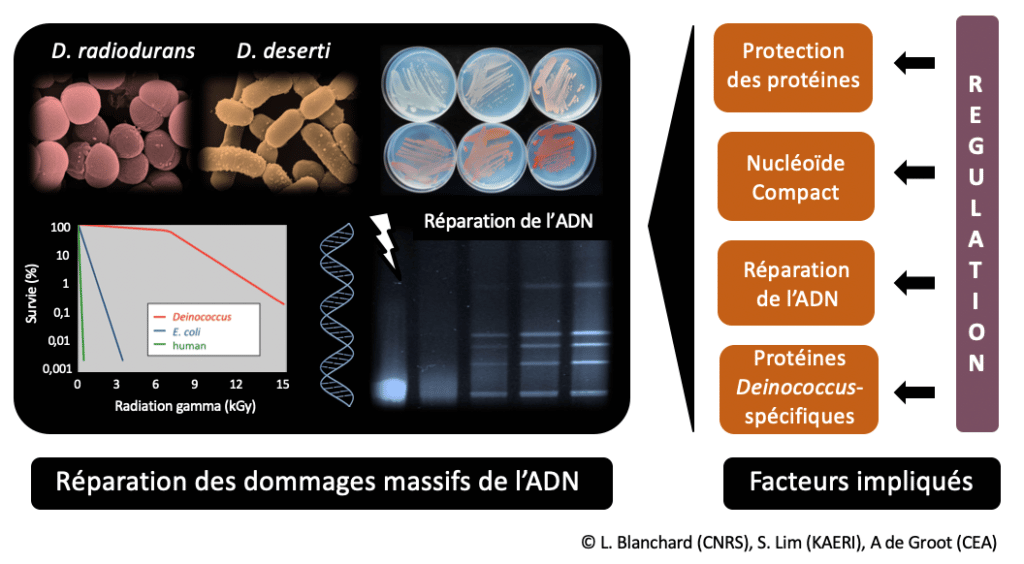
Les bactéries Deinococcus, coques ou bâtonnets, présentent des colonies colorées sur boîtes de Pétri dû à la présence de caroténoïdes. Ces bactéries tolèrent des doses de rayonnement ionisant beaucoup plus élevées que la plupart des bactéries et les cellules humaines (pas de perte de survie à 5000 Gray (Gy) alors qu’une dose de 10 Gy est létale pour l’homme). Cette résistance extrême est liée à la capacité des Deinococcus à reconstituer un génome intact à partir d’un génome fragmenté par l’irradiation, incluant une réparation efficace de nombreuses cassures double-brin qui sont létales pour la plupart des organismes (De Groot et al. (2009) PLoS Genet) (Figure 1).
Leur secret, découvert pas à pas au cours des dernières années, réside dans une combinaison de nombreux facteurs et mécanismes de réparation et de protection finement régulés (Lim, Jung, Blanchard, De Groot (2019) FEMS Microbiol Rev). De nombreux mécanismes et fonctions de nouvelles protéines restent cependant encore à décrypter.
Comprendre comment les Déinocoques résistent aux radiations peut conduire à une meilleure compréhension de ce type de résistance chez d’autres organismes ou cellules (notamment certaines cellules cancéreuses présentant une résistance accrue aux radiothérapies), ou inversement, comprendre pourquoi certaines cellules sont plus radiosensibles que d’autres.
Approches utilisées
Les approches globales, de protéo-génomique ou transcriptomique (RNA sequencing) différentielles, que nous utilisons permettent de sélectionner des gènes/protéines en lien avec la radiorésistance. Les cibles (e.g. gènes/protéines radio-induit(e)s, impliqué(e)s dans la réparation de l’ADN, spécifiques aux Deinococcus ou à D. deserti) sont ensuite caractérisé(e)s par génétique et biochimie structurale.
Projets principaux en cours
Dans le cadre du projet ANR NOVOREP, nous étudions D. deserti (Cadarache) et Deinococcus radiodurans (collaboration I2BC, Paris Sud) et poursuivons la caractérisation du mécanisme de réponse au stress indépendant du système SOS que nous avons découvert et qui est contrôlé par deux régulateurs clés, IrrE & DdrO (Figure 2). Après exposition au stress, l’induction de plusieurs gènes de réparation de l’ADN se produit après clivage du répresseur transcriptionnel DdrO par la métalloprotéase IrrE, essentielle pour la radiorésistance. Nous avons récemment décrit que la fonction peptidase de IrrE est activée par une augmentation de la disponibilité du zinc après stress, montrant pour la première fois chez les procaryotes un rôle du zinc comme messager secondaire dans la signalisation rédox. Nous avons également résolu la structure 3D de DdrO, permettant de mieux comprendre le mécanisme de (dé)répression au niveau moléculaire.
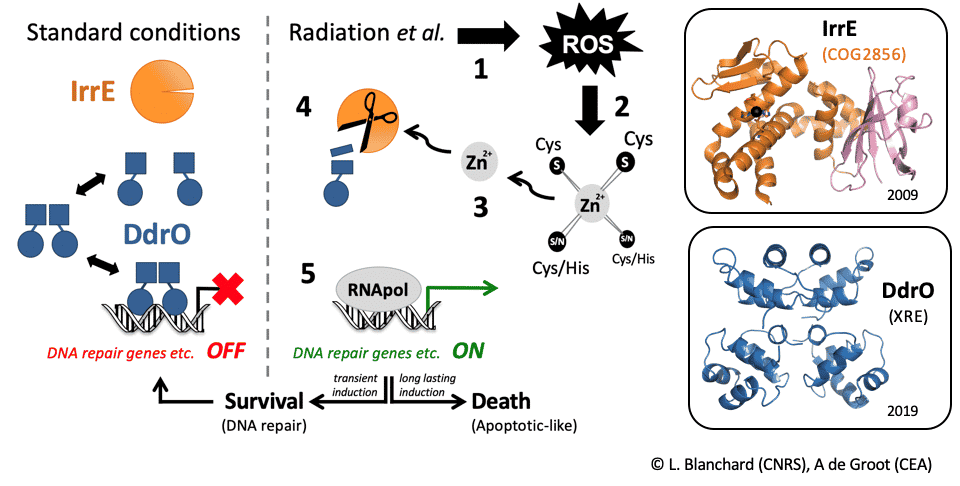
Des paires de protéines similaires à IrrE et DdrO sont retrouvées chez de nombreuses bactéries environnementales, pathogènes ou utilisées dans l’industrie, dans lesquelles elles contrôlent la production de phages ou pourraient contrôler la production de toxines induisant la dormance et la tolérance aux antibiotiques de certains pathogènes. La caractérisation de ces couples permettra d’avoir une vision d’ensemble du fonctionnement de cette nouvelle et grande famille de régulateurs, ouvrant la voie au développement de stratégies pour contrecarrer les effets préjudiciables de certains d’entre eux en santé humaine.
L’exploration de la biodiversité que nous avons réalisée via une analyse comparative de 11 espèces de Deinococcus a révélé la conservation et la diversité de protéines impliquées dans la réparation de l’ADN et la défense contre le stress oxydant, et a également mis en évidence diverses protéines non caractérisées (Lim et al., 2019). Dans le cadre d’un projet transverse au sein de l’Institut avec Pascal Rey (PPV) et d’un partenariat Hubert Curien avec nos collaborateurs du KAERI en Corée du Sud, nous avons commencé de caractériser un réseau de thiol-réductases présentant des caractéristiques originales. Ce projet vise à créer un consortium international de « Biologie rédox ».
Absorption des métaux et métalloprotéines
Par Pascal Arnoux
Les métaux essentiels (aussi appelés micronutriments) sont des ressources vitales pour tout organisme vivant. L’homéostasie des métaux (absorption et sécrétion des métaux ainsi que la régulation de ces fonctions) est donc un processus important et fondamental. Bien qu’ils présentent des similitudes fonctionnelles générales, les mécanismes sous-jacents sont extrêmement divers.
Le meilleur exemple est peut-être celui de l’absorption du fer par les organismes vivants, qui est relativement peu disponible dans de nombreux environnements, notamment en présence d’oxygène qui oxyde et précipite le fer. Ces conditions de non biodisponibilité se trouve également à l’interface entre un hôte et un pathogène, situation dans laquelle l’hôte limite la disponibilité du métal, précisément pour empêcher la croissance bactérienne dans un processus appelé « immunité nutritionnelle ». Face à cette ressource rare et vitale, les bactéries s’adaptent pour synthétiser des sidérophores de haute affinité pour le fer, qu’elles exportent dans l’espace extracellulaire avant la capture et l’import du complexe sidérophore-Fe3+. Ces sidérophores sont fréquemment associés à la virulence et peuvent également être utilisés pour le transport d’autres métaux que le fer, les exemples d’autres types de métallophores microbiens étant peu nombreux.
Dans ce contexte, nous avons décrit en 2016 un nouveau type de métallophore chez des bactéries pathogènes (Staphylococcus aureus et Pseudomonas aeruginosa ; cf. Figure ci-dessous). Ces métallophores sont apparentés à la nicotianamine, un métabolite végétal utilisé pour l’absorption et le transport à longue distance de divers micronutriments. Chez les bactéries, ces métallophores de type nicotianamine sont principalement dédiés à l’absorption du zinc dans des environnements chélateurs, qui prévalent à l’interface hôte-pathogène ou bien dans les sols calcaires et certains environnements marins. Depuis ces découvertes, nous poursuivons ces recherches en étudiant la diversité, la régulation, le rôle et l’évolution des métallophores de type nicotianamine dans différents modèles bactériens.
L’équipe Metallo est organisée autour d’un PI (Pascal Arnoux), de 2 supports techniques et d’ingénierie (Catherine Brutesco et Géraldine Brandelet) et d’une doctorante (Manon Dassa-Valzer).
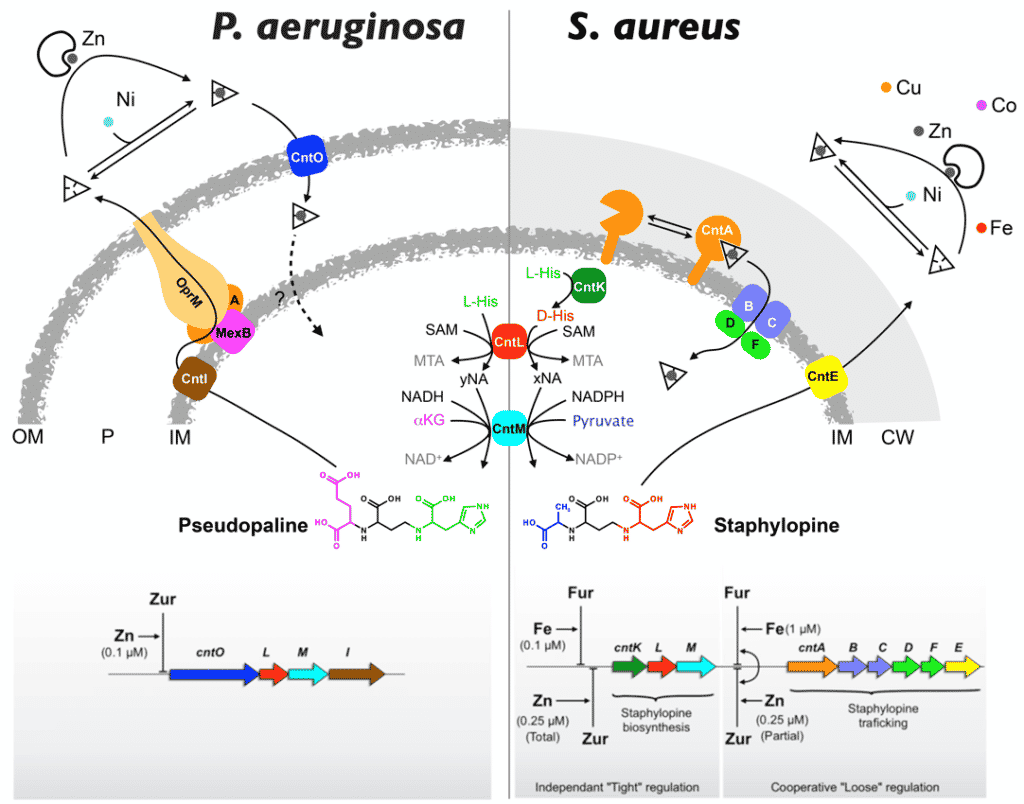
Figure 1 : Modèle de production et de trafic de métallophores de type nicotianamine chez P. aeruginosa et S. aureus. Alors que la voie cnt et sa régulation sont plutôt bien établies dans le cas de S. aureus, quelques points d’interrogation subsistent dans le cas de P. aeruginosa, comme le sort de la pseudopaline lorsqu’elle est importée sous forme de complexe métallique et comment le métal associé est finalement importé.
Outre cette activité principale, je m’intéresse également à l’étude des métalloprotéines et à leur caractérisation structurale. Les collaborations en cours comprennent l’étude de la liaison de l’uranium à la protéine UipA avec V. Chapon, IPM, la caractérisation d’une photoenzyme produisant des alkanes (FAP) avec D. Sorigue et F. Beisson, EBM au sein du BIAM et la caractérisation d’une nouvelle famille de formate déshydrogénase à molybdène avec A. Walburger et A. Magalon, IMM, Marseille et FhtR, un capteur d’hème avec D. Lechardeur, Micalis, INRAE, Jouy-en-Josas.
Biominéralisation microbienne (MicroBioMin)
MicroBioMin
Notre groupe étudie les mécanismes conduisant aux formations de biominéraux par les microorganismes et la capacité de ces microorganismes à naviguer efficacement dans des environnements complexes
Nos objectifs englobent ainsi la compréhension des rôles joués par les microorganismes dans les cycles biogéochimiques et pour le climat, la compréhension des micro-nageurs biologiques et le développement de micro-nageurs efficaces pour diverses applications, ainsi que l’avancement respectif des voies bio-inspirées et durables vers des matériaux avancés. Nous sommes particulièrement intéressés par les organismes magnétotactiques formant des cristaux ferrimagnétiques, et par les algues coccolithophores formant des écailles calciques. Nos voies de recherche reposent sur la combinaison d’approches environnementales et de laboratoires développés en interne, principalement in situ. Nous utilisons une combinaison de techniques analytiques incluant la microfluidique, la microscopie électronique et optique, la spectromicroscopie à rayons X, ainsi que des techniques de omics.
Nos thématiques
1. Investigation des processus de biominéralisation au plus près de l’état natif
Par Daniel Chevrier

Nos recherches portent sur la formation de nanomatériaux inorganiques et de minéraux via les processus de biominéralisation, qui font intervenir des molécules biologiques et des modèles produits par des organismes qui dirigent et contrôlent la minéralisation. Globalement, la révélation des composants et des étapes nécessaires à la biominéralisation réalisée par les microorganismes est un moyen d’adapter les stratégies de synthèse pour produire des nanomatériaux microstructurés avec un meilleur contrôle de leur morphologie et de leur taille.C’est aussi un moyen de mieux comprendre l’impact de la formation de biominéraux sur notre environnement.
Les projets actuels visent à approfondir notre compréhension des processus de biominéralisation en examinant la formation de nanoparticules de magnétite par des bactéries magnétotactiques (magnétosomes) et de coquilles de calcite nanostructurées par des microalgues coccolithophores (coccolithes) dans des conditions d’état natif (vitrifié, en liquide, in situ). Cela implique une combinaison de mesures de spectroscopie et de microscopie à rayons X basées sur le synchrotron, ainsi que des environnements d’échantillons microfluidiques pour capturer la formation de biominéraux dans des microorganismes individuels. Les études sont conçues pour fournir des analyses sans précédent au niveau de la cellule unique sur le processus de biominéralisation, comme l’absorption des ions métalliques, le stockage des métaux, le taux de formation des biominéraux et l’identification des précurseurs et intermédiaires pertinents.
2. Interactions entre le Vivant et l’inanimé : mettre les gènes au menu de la science des matériaux et de la matière molle condensée
Par Damien FAIVRE

Je réalise des études interdisciplinaires sur les microsystèmes fonctionnels et les nanomatériaux. Les bactéries magnétotactiques et leur chaîne de magnétosomes représentent un exemple frappant où un organisme vivant très simple contrôle précisément les propriétés des éléments constitutifs individuels (taille et forme des nanoparticules) ainsi que leur assemblage à l’échelle nanométrique pour naviguer efficacement dans des environnements complexes. Je développe donc une recherche bio-inspirée basée sur les organismes unicellulaires biominéraux (bactéries magnétotactiques et algues coccolithophores), qui vise respectivement à comprendre comment les systèmes biologiques synthétisent, organisent et utilisent les minéraux, et comment ils se déplacent. Mon objectif est d’appliquer les principes de conception pour former de manière durable des matériaux fonctionnels qui peuvent être utilisés, par exemple, comme nanodispositifs magnétiques pour des applications en médecine. Enfin, je développe une nouvelle direction de recherche sur les nanoparticules et les plantes. J’utilise des techniques analytiques à haute résolution, de préférence in situ et in vivo, telles que la microscopie électronique, la diffraction des rayons X par synchrotron et la spectroscopie d’absorption ou la microscopie à cadre ouvert développée en interne. Ces techniques sont combinées à la microfluidique lorsque cela est possible afin d’approcher les phénomènes dynamiques aussi près que possible de leur état natif.
Responsable d’équipe Pascal ARNOUX
Responsable adjointe Laurence BLANCHARD
Responsable adjoint Damien FAIVRE
Mots clés
Génomique, génétique bactérienne, biologie moléculaire, microbiologie, purification de proteines recombinantes, biochimie, biologie structurale, biophysique, enzymologie.